Cohésion dans un solide ionique ou non, interactions électriques entre ions |
Cohésion dans un liquide (cas des solvants). Modélisation des interactions électriques intermoléculaires, entre molécules polaires ou apolaires, cas spécifique de la liaison hydrogène
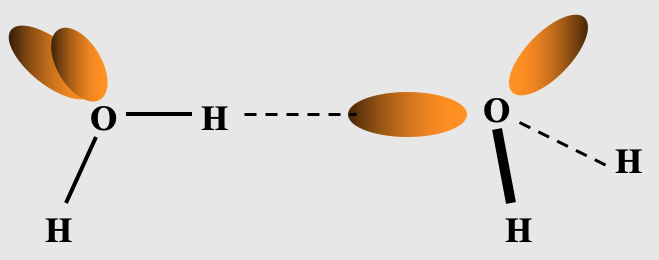
|
(AD 01) Interact° électriques entre entités chimiques : Expliquer la cohésion au sein de composés solides ioniques, au sein des solides ou liquides moléculaires par l’analyse des interactions électriques entre entités |
Dissolution des solides ioniques
dans l’eau
Équation de réaction de dissolution
Concentrations apportée (notée C espèce) et réelles ou effective (notée entre crochets) |
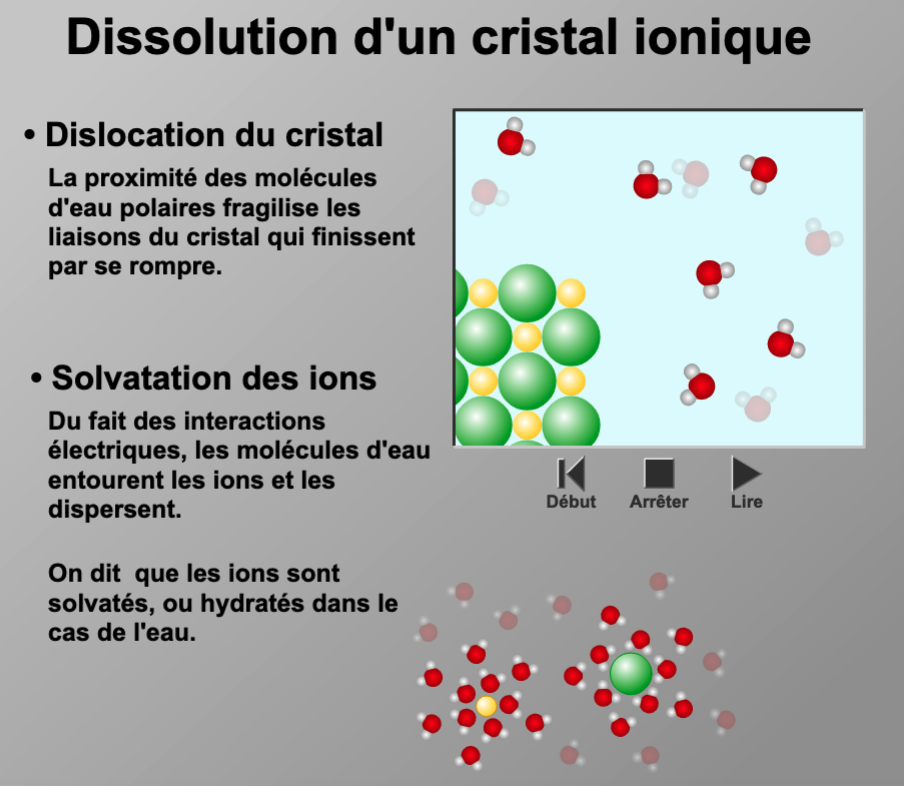
|
(AD 02) Exos (01) : Dissolution d'un solide ionique
Modélisation au niveau macroscopique, de la dissolut° d’un composé ionique dans l’eau par une équat° de réact° en utilisant les notations (s) et (aq). Calcul de la concentration réelle des ions en solution
(AD 02 (bis) : à réaliser en solo |