CH4(g) + 2 O2(g) --> CO2(g) +2 H2O(g). ................................................+ 800 kJ *
.
..800 kJ est la valeur de l'énergie émise lors de la
formation de 1 mol de dioxyde de carbone, de 2 mol d’eau, émise lors de la destruction de 1 mol de méthane et de 2 mol de dioxygène
est une réaction exo ... thermique |
Diagramme énergétique (combust° de 1 mol de méthane)
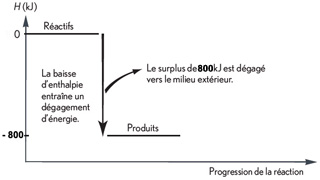 Les énergies sont aussi appelées enthalpie. La référence des énergies peut être prise arbitrairement (0 kJ) pour l 'ensemble des réactifs. L'enthalpie H de l'ensemble des produits est alors plus faible * pour une combustion Les énergies sont aussi appelées enthalpie. La référence des énergies peut être prise arbitrairement (0 kJ) pour l 'ensemble des réactifs. L'enthalpie H de l'ensemble des produits est alors plus faible * pour une combustion
|
| L'énergie (émise lors d'une combustion) est toujours rapportée à la quantité de matière (ou à la masse) de combustible utilisée. On exprime ce "pouvoir calorifique" molaire en * kJ/mol, massique en kJ/kg |
dans ce cas, la chaleur de réaction appelée aussi variation d’enthalpie H(produits) - H(réactifs) correspond à l’énergie émise vers l'extérieur
|
. Cette émission d'énergie est traduite ... - soit en faisant apparaitre la valeur absolue à droite de l'équat° de réact° pour montrer qu'elle est produite ........ ... - soit en faisant apparaitre que le valeur de la variat° d’enthalpie est négative : H(produits) - H(réactifs) < 0 |